近日,我校生物工程学院细胞功能调控与化学干预科研团队在国际顶级学术期刊ACS NANO(IF=14.588)上发表了题为“Polyethyleneimine-Modified Mesoporous Silica Nanoparticles Induce a Survival Mechanism in Vascular Endothelial Cells via Microvesicle-Mediated Autophagosome Release”(DOI: org/10.1021/acsnano.1c03456)的研究论文。该团队张璐教授、2019级硕士研究生冯高青和杨硕晔副教授为共同第一作者,张璐为通讯作者。
介孔二氧化硅纳米颗粒(MSN)近年来被广泛应用于药物传递、基因载体、诊断和生物成像等领域。与其他纳米载体相比,MSN具有良好的生物相容性、高载药量、无早释、特异性靶向给药和活性成分的控制释放等优点,使MSNs成为最有前途的药物载体。由于血管内皮细胞是血液和组织交换的“第一屏障”,进入循环的MSNs会直接与血管内皮细胞接触,评估MSNs对血管内皮细胞的影响对于纳米颗粒的安全应用意义重大。
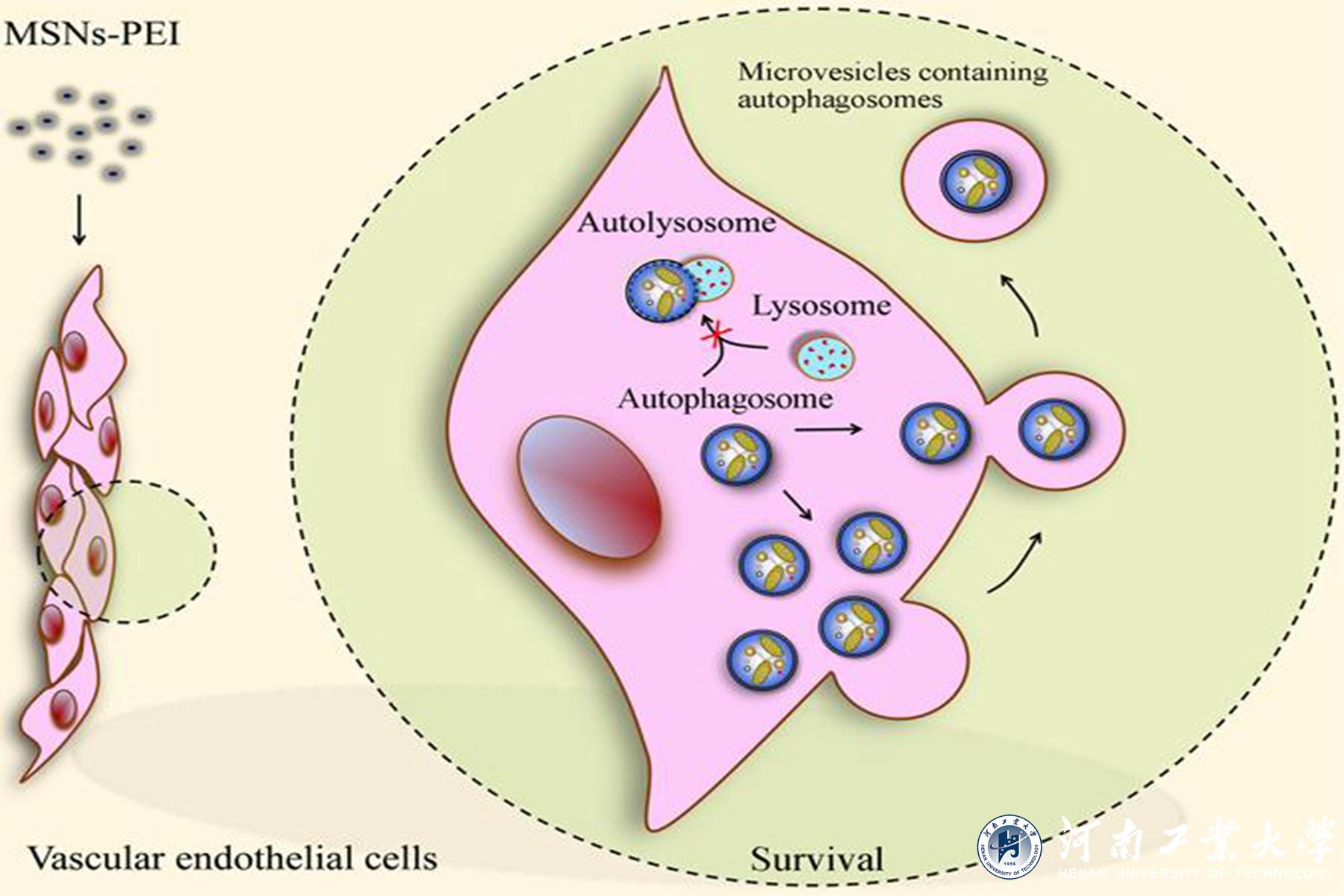
与未修饰的MSNs、氨基修饰的MSNs或脂质体包裹的MSNs不同,100 μg/ml聚乙烯亚胺修饰的MSNs(MSNs-PEI)对人脐静脉内皮细胞无明显毒性。然而,MSNs-PEI阻断自噬小体与溶酶体的融合,诱导自噬小体积聚,这是许多纳米颗粒毒性的核心机制。据此,研究者预测在血管内皮细胞中存在一种自噬小体清除的替代途径来减轻MSNs-PEI诱导的自噬应激。进一步研究发现,MSNs-PEI诱导细胞骨架结构改变,但不引起内质网应激,当MSNs-PEI阻断自噬小体降解时,积累的自噬小体通过微泡释放到细胞外空间。阻断自噬小体的形成或释放会导致受损线粒体堆积和活性氧的过量产生,进而导致血管内皮细胞死亡。该研究在国际上首次证实当纳米颗粒阻断了自噬小体降解时,细胞产生一种缓解自噬压力的补偿机制,即通过微体介导自噬小体释放到胞外,维持血管内皮细胞稳态。因此,促进积累自噬小体的释放可能是对抗纳米颗粒血管毒性的一种新的保护策略。
生物工程学院高度注重科研团队建设,大力支持教师科研工作,细胞生物学研究小组已先后获得8项国家自然基金项目支持,已先后在细胞自噬方向国际顶级期刊Autophagy(IF=11.059)等发表10余篇高水平论文。该工作得到国家自然科学基金(32070742和31471296)、河南省科技攻关计划(192102310148)等项目的资助。
